一文解读:质粒载体及各个组成元件
一、什么是载体?
1、把一个目的基因通过基因工程手段送到生物细胞(受体细胞),主要目的是分离、纯化及表达特定的基因,此过程中需要运载工具(交通工具)携带外源基因进入受体细胞,这种运载工具就叫做载体(Vector)。
2、基因工程上所用的载体是一类能自我复制的DNA分子,其中的一段DNA被切除而不影响其复制功能,可用以置换或插入外源(目的)DNA而将目的DNA带入受体细胞进行表达,主要包括质粒、噬菌体、病毒等。
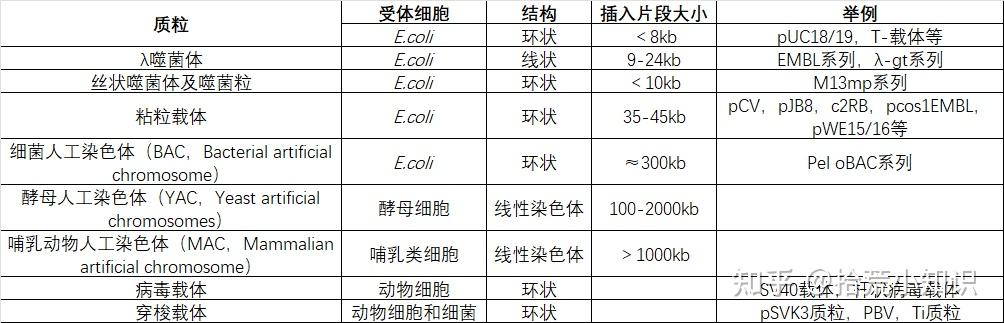
二、载体的分类
1、载体按属性可以分为:
(1)病毒载体,常见的分子生物学工具,可将遗传物质带入细胞;
(2)非病毒载体,一般是指质粒DNA;
2、按进入受体细胞的类型可以分为:
(1)原核载体
(2)真核载体
(3)穿梭载体(含原核和真核2个复制子,能在原核和真核细胞中复制,并可以在真核细胞中有效表达)。
3、如果按功能分类,可以分为:
(1)克隆载体:具有克隆载体的基本元件(Ori,Ampr,MCS 等),可以携带DNA 片段或外源基因进入受体细胞并克隆和大量扩增DNA 片段(外源基因)的载体;
(2)表达载体:这种载体中加入一些与表达调控(具有转录/翻译所必需的DNA 序列)有关的元件即成为表达载体。
4、按性质分:
(1)融合型载体
(2)非融合型载体
三、什么是质粒?具有哪些特征?
1、质粒的定义
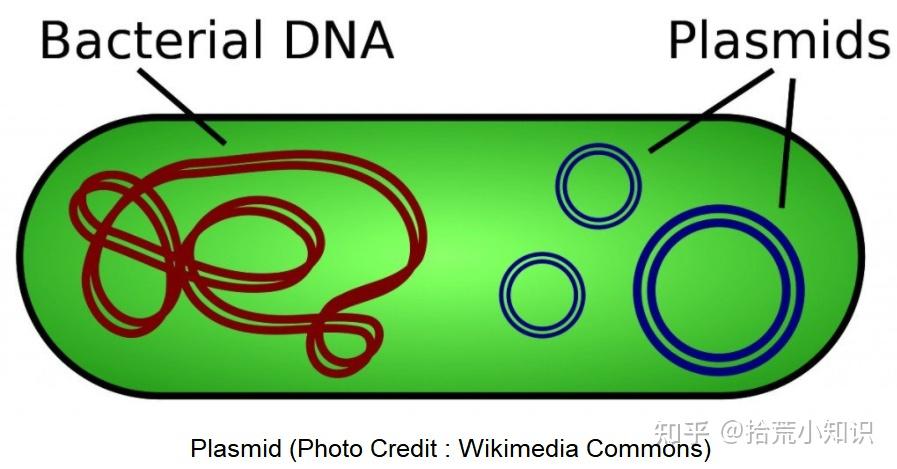
质粒通常被定义为圆形的、双链的染色体外DNA。我们知道,每个细胞都有一个细胞核或核区域,包含了细胞的所有遗传物质。但原核细胞和部分真核细胞,拥有额外的DNA,能独立于细胞染色体而自主复制、并被稳定遗传的一类核酸分子。这个额外的DNA被称为质粒。它是双股的,通常是圆形的,这意味着它连接在一起形成一个圆。
天然DNA质粒大都具有共价、封闭、环状的分子结构,其分子量范围:1-300 kb。
2、质粒的基本特征
质粒的自主复制性(可扩增性):质粒能利用寄主细胞的DNA复制系统进行自主复制,并根据在每个细胞中的分子数(拷贝数)多寡,质粒可分为两大复制类型:严紧型复制控制的质粒1~3拷贝;松弛型复制控制的质粒 10~60拷贝,不过即使是同一质粒,其拷贝数在不同的寄主细胞间和不同的生长环境也可能有很大的变化。
质粒的不相容性:任何两种含有相似复制子结构的不同质粒,不能同时存在于一个细胞中,这种现象称为质粒的不相容性,不相容性的质粒组成不相容性群。以大肠杆菌的质粒为例:
ColE1、pMB1 拥有相似的复制子结构,彼此不相容。
pSC101、F、RP4 拥有相似的复制子结构,彼此不相容。
p15A及其衍生质粒拥有相似的复制子结构,彼此不相容。
质粒的可转移性:革兰氏阴性菌的质粒可分成两大类:
接合型质粒——能在天然条件下自发地从一个细胞转移到另一个细胞(接合作用),如F、Col、R质粒等。
非接合型质粒——不能在天然条件下独立地发生接合作用如Col、R的其它成员。
携带特殊的遗传标记:野生型的质粒DNA上往往携带一个或多个遗传标记基因,这使得寄主生物产生正常生长非必需的附加性状,包括:
物质抗性:抗生素、重金属离子、毒性阴离子、有机物等。
物质合成:抗生素、细菌毒素、有机碱等。
这些标记基因对DNA重组分子的筛选具有重要意义。
3、为何质粒成为广泛应用的生物学工具?
(1)质粒不仅仅是修饰细菌和酵母等生物,质粒也可以在正常的细胞分裂过程中随细胞一起复制,也可以自行复制。
(2)易于分离:很容易从宿主细胞中分离出来。
(3)质粒上可以进行特殊标记,十分利于筛选和鉴别。
(4)质粒存在重组DNA所需的某些区域,如复制起点(origin of replication)。
(5)质粒在尺寸上相比于基因组是很小的,它们相对来说更加易于研究和改造。
四、如何阅读一个完整的质粒图谱?
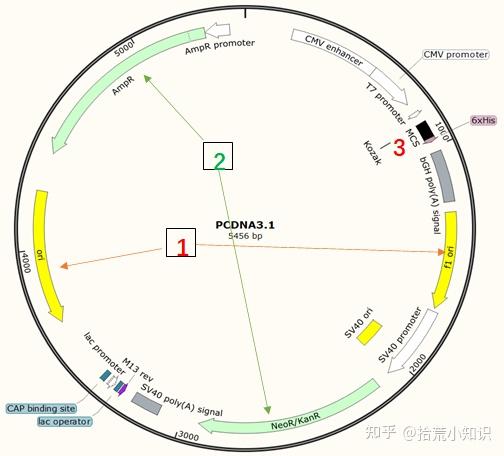
首先看质粒图谱包含的4大要素:
1、复制起点(ori):控制着质粒的复制,并决定了质粒的宿主属性和拷贝数;
2、筛选标记:多为抗性基因,以便加以检测筛选(包括原核抗性、真核抗性);
3、多克隆位点区:外源基因的插入位点;
4、其他元件:如转录调控元件、翻译表达元件和蛋白标签等。
1、复制起点(Ori/origin)
图谱中的ori表示质粒的复制起点,ori及其控制的组分一起称为一个复制子。质粒的复制起点决定了质粒的宿主及质粒的拷贝数,具有相同ori的质粒不可共转染(质粒的不相容性)。
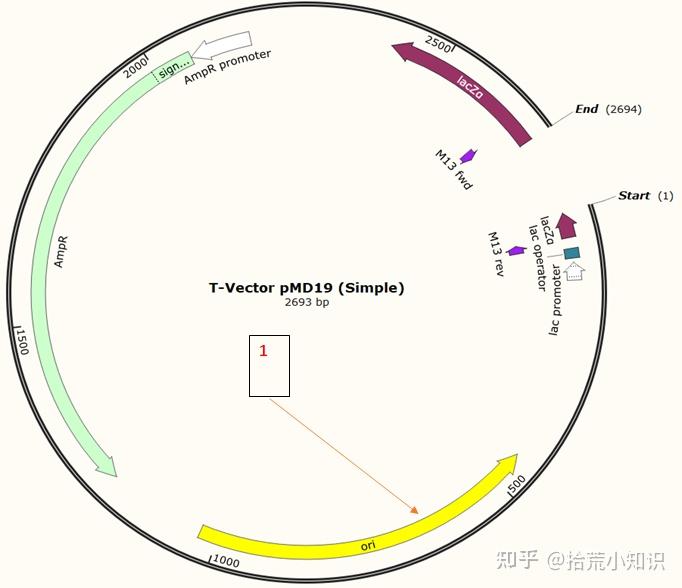
若图谱上只有一个ori,表示质粒是原核克隆及表达质粒(例如T载体)。
若图谱上有两个ori,则表示该质粒是穿梭质粒,既可以在原核也可以在真核中复制。
Ori复制子:遗传信息传给后代的首要条件就是它至少要具有一个复制原(ori, origin of replication), 使整个基因体得以复制。含有复制原的遗传物质称为 replicon,复制子。
2、筛选标记
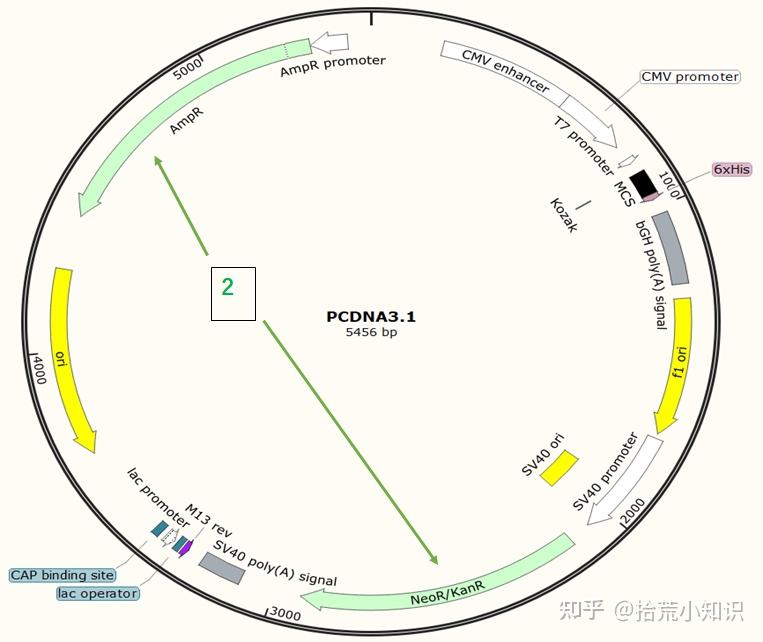
图谱中的AmpR、KanR等表示质粒载体中的筛选标签,多为抗生素抗性基因,方便后续通过抗生素筛选阳性克隆。只存在单抗性的质粒多为原核克隆载体和原核表达载体(例如T载体) 。而存在两种或以上的抗性的多为穿梭质粒(如pcDNA3.1)。
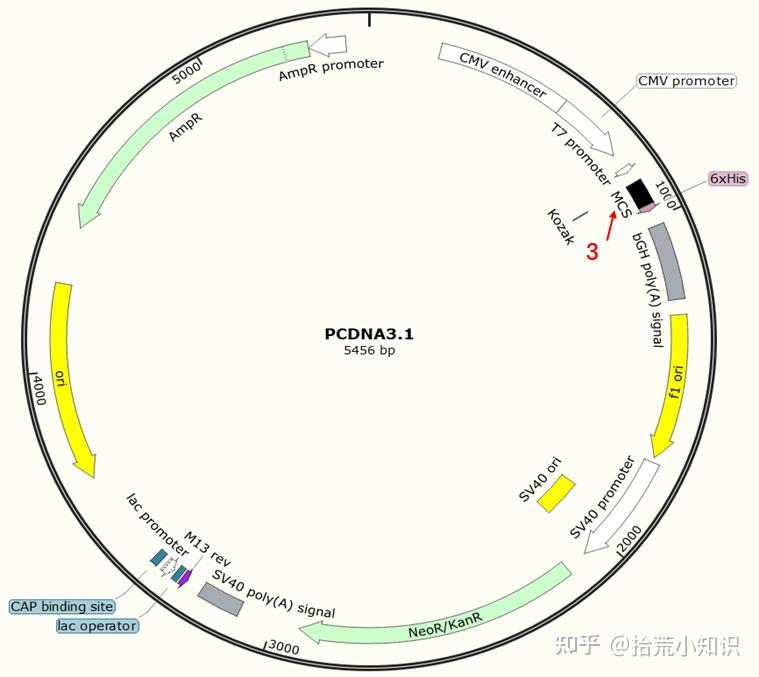
3、多克隆位点区(Multiple Cloning Site,MCS)
是一段用于插入外源DNA片段的特定区域,由一系列的紧密相连的限制性内切酶位点组成,而且每个限制性内切酶位点在整个载体中是唯一的。一般可通过酶切后连接的方式将外源DNA插入质粒。多克隆位点一般位于转录启动和转录终止信号之间。
4、其他调控元件
质粒载体中除复制起始位点、筛选标记、多克隆位点外,还具有其他一些表达或调控元件,如转录调控和翻译调控元件和融合表达标签蛋白等。
五、特殊元件或特殊序列
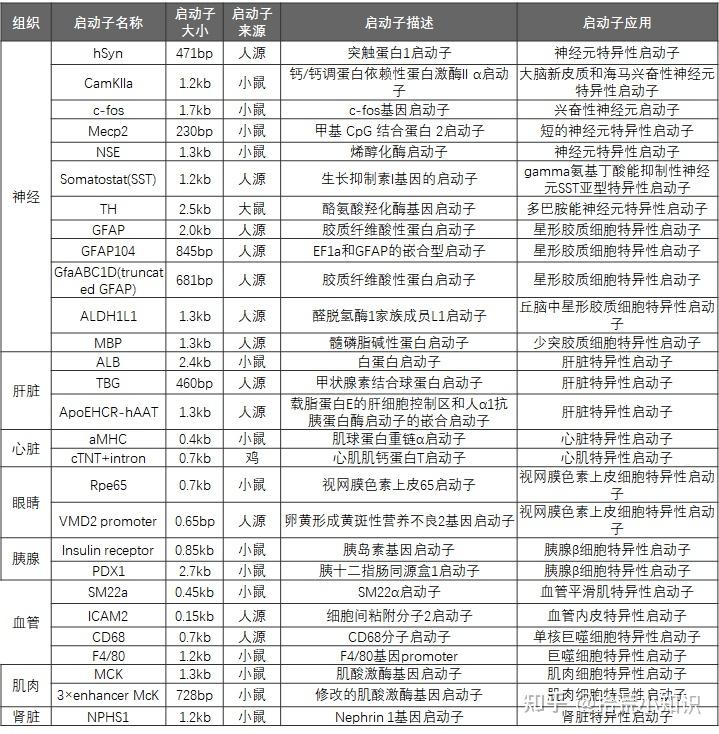
1、启动子
启动子通常分为三类:组成型/广谱启动子,组织/细胞基因特异性启动子,诱导表达启动子。
(1)组成型/广谱启动子:
组成型启动子是在组成型启动子的调控下,不同组织器官和发育阶段的基因表达没有明显差异。组成型启动子的调控不受外界条件的影响,所启动基因的表达具有持续性,但不表现时空特异性,亦称之为非特异性表达启动子。常见组成型启动子如下:
(2)组织/细胞基因特异性启动子:
亦称之为器官特异性启动子,是指在该启动子调控下,外源基因的表达一般只发生在某些特定的器官或组织部位,并往往表现出发育调节的特性。其最大的优点是它所启动的外源基因在受体中仅在需要的部位特异表达,从而克服了组成型启动子启动的外源基因在受体中非特异、持续、高效表达所造成的浪费,增加转基因的效果。特别在腺相关病毒载体中,特异性启动子应用尤为广泛。
(3)诱导表达启动子:
指在某些特定的物理或化学信号的刺激下,该种类型的启动子可以大幅度地提高基因的转录水平,常见是四环素诱导表达启动子,一些代表载体为GV308 TetIIP-MCS-3FLAG-Ubi-TetR-IRES-Puromycin (过表达慢病毒载体)和GV307 TetIIP-TurboRFP-MCS(MIR30)-Ubi-TetR-IRES-Puromycin (干扰慢病毒载体)对于某些特定的有毒基因,使用诱导表达启动子载体是一个可行的解决方案。
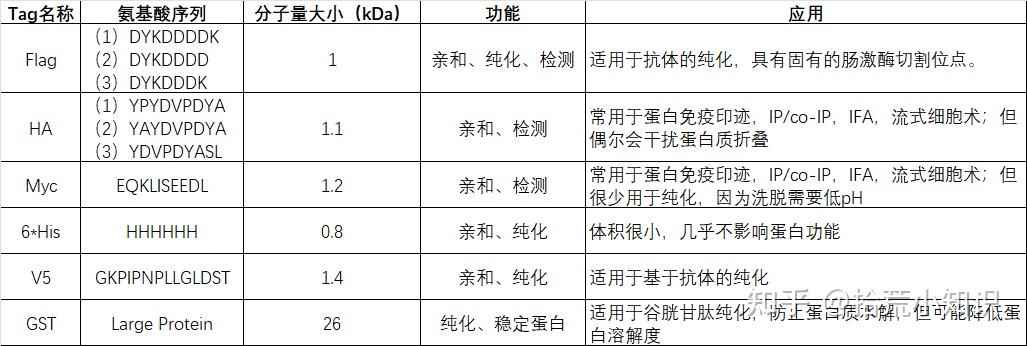
2、标签序列
标签,通常是相对较小的氨基酸序列。如果研究的是未鉴定的蛋白,或者尚未开发出优质抗体的蛋白(仅仅是因为研究的蛋白具有可商购的抗体,那并不意味着它是优质的),那么第一步就是检测,免疫沉淀或将亲和标签融合到蛋白上再纯化蛋白。标签选择建议:
(1)如果是编码基因,可以考虑增加一个标签,有利于后续的检测;
(2)有些标签多串联几个,比如3*FLAG,3*HA等,可以增加检测的灵敏度;
(3)标签的位置,理论上标签可以放在目的基因的5’端和3’端,通常默认放在基因的3’端,但是具体需要根据目的基因的功能考虑,比如目的基因是否有信号肽,目的基因的C端后期是否会被切除等,这些因素都会决定标签的位置。
(4)有些标签较大,举例GST标签,可以考虑增加蛋白酶比如Thrombin,增加到GST与目的基因之间,后期可以很方便的将GST标签切除。
3、Kozak序列
它是位于真核生物mRNA 5’端帽子结构后面的一段核酸序列,通常是GCCACCAUGG,它可以与翻译起始因子结合而介导含有5’帽子结构的mRNA翻译起始。对应于原核生物的SD序列。存在于真核生物mRNA的一段序列,其在翻译的起始中有重要作用。
所谓Kozak规则,即第一个AUG侧翼序列的碱基分布所满足的统计规律,若将第一个AUG中的碱基A,U,G分别标为1,2,3位,则Kozak规则可描述如下:
(1)第4位的偏好碱基为G;
(2)AUG的5’端约15bp范围的侧翼序列内不含碱基T;
(3)在-3,-6和-9位置,G是偏好碱基;
(4)除-3,-6和-9位,在整个侧翼序列区,C是偏好碱基。 Kozak规则是基于已知数据的统计结果,不见得必须全部满足,一般来说,满足前两项即可。
真核引物设计需在AUG前加上GCCACC。
4、poly(A) tail
poly(A) tail:真核生物mRNA的3’端都存在的一段序列,可以起到稳定mRNA的作用:
(1)这种尾巴不由基因编码,而是在转录后加到mRNA上的。加尾过程受位于终止密码3’端的加尾信号序列所控制。
(2)在结构基因的最后一个外显子中有一个保守的AATAAA序列,此位点下游有一段GT丰富区或T丰富区,这两部分序列共同构成poly(A)加尾信号。
(3)哺乳动物细胞表达质粒主要是用于转录出mRNA,常用的转录终止子有SV40,hGH,BGH和rbGlob,同时包含有AAUAAA基序促进聚腺苷酸化和转录终止。除了上面列出的,SV40 late polyA 和rbGlob polyA被认为可以更加有效的终止转录。
有一点特别需要注意的是,哺乳动物细胞的poly(A)信号和病毒包装系统的联合使用可能会降低病毒滴度,延长转录本的寿命,所以处理的时候需要谨慎一点。因为这个原因,病毒载体通常会使用其他非poly(A)的转录本稳定元件和出核元件,如WPRE和CTE或者使用其他弱的poly(A)信号,如BGH 。
5、WPRE序列
WPRE是一段顺式作用的RNA元件,为转录后调控序列,放在多聚腺苷酸化信号之前可显著增加mRNA的表达水平和翻译效率,进而增强基因的表达,并且WPRE插入病毒载体中还可以大大提升病毒包装的滴度。而且一般双启动,都是在后面一个加WPRE元件。
事实上,每个基因转录确实需要一个poly A来结尾提高mRNA的稳定性,但慢病毒由于中间不可以有poly A,否则转录就会被提前中断,因此确实也牺牲了一部分RNA的稳定性,甚至有时还会造成两个启动子的相互干扰。
6、IRES序列
IRES元件非常有用,通常在双顺反子载体中应用最多。核糖体在遇到下一个基因之前会离开mRNA,因为在一个基因翻译结束之后,核糖体就会遇到终止子,然后从mRNA上脱离。在遇到IRES后,可以再重新结合到mRNA上进行翻译。起到良好的“再启动”作用。但是其缺点是元件非常大(500-600 bp),可能会在包装能力有限的病毒转移载体中占据宝贵的空间。
六、完整观察一个质粒图谱
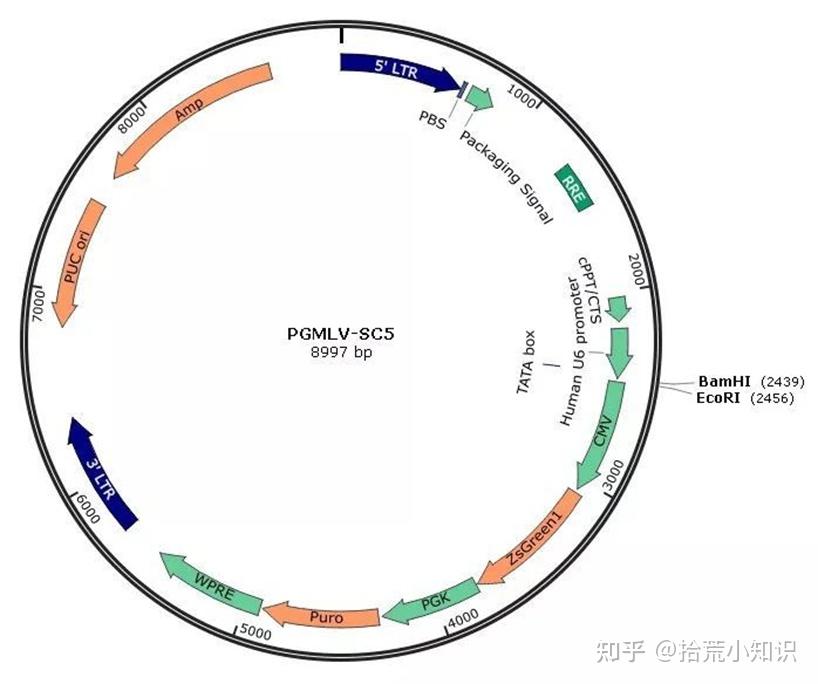
pUC ori:复制起始点,pUC为高拷贝表达质粒(120-200个/细胞)。
PBS:引物结合位点。
RRE:与REV蛋白结合,将未剪切的载体转录产物从胞核转运至胞浆,提高病毒颗粒产生效率。
cPPT/CTS:中央多聚嘌呤区,使病毒载体不受细胞分裂控制,允许广泛细胞类型的有效转导。
U6 promoter:U6启动子,真核启动子,启动shRNA的表达。
CMV:真核启动子,启动ZsGreen1的表达。
ZsGreen1:第三代绿色荧光蛋白,亮度最高的荧光蛋白。
PGK:真核启动子,启动Puro的表达。
Puro:嘌呤霉素抗性基因,真核抗性,用于质粒或病毒进入细胞后的筛选。
Amp:氨苄抗性基因,原核抗性,用于质粒抽提时的筛选。
WPRE:转录后调控序列,增加外源片段的表达效率。
3’LTR、5'LTR:逆转录病毒基因组两端各有一个长末端重复序列(5'-LTR和3'-LTR),不编码蛋白质,含有启动子,增强子等调控元件。
七、如何改造一个质粒?
天然存在的野生型质粒由于分子量大、拷贝数低、单一酶切位点少、遗传标记不理想等缺陷,不能满足克隆载体的要求,因此往往需要以多种野生型质粒为基础进行人工构建。需满足以下改造原则:
(1)一般载体越小,转化的效率越高;小的载体外源DNA片段的装载量更大。因此,要删除天然质粒不必要的DNA区域,尽量减小质粒的相对分子质量。
(2)在质粒上引入含有多种限制酶切割位点的多克隆位点,以便外源基因的重组。一般还要删除重复的限制酶切割位点,使环状的质粒经限制酶处理后只在一处断裂,从而保证外源基因的准确插入。
(3)加入易于识别的选择性标记,如各种抗生素抗性基因,以便检测重组质粒是否成功进入受体细胞。
(4)为了保证实验的安全性,杜绝重组质粒扩散,污染环境,要灭活某些质粒的编码基因,如促进质粒在细菌间转移的mob基因。为了提高质粒的拷贝数,还要灭活那些抑制质粒复制的基因。
(5)在质粒中引入特定用途的辅助序列,以满足更多的实验要求。例如,引入LacZ基因用于蓝白斑筛选;引入用于检测和分离表达产物的标签编码序列,如多聚组氨酸标签、由8个氨基酸组成的Flag-tag标签等。
Ps:如有错误或者疑问,欢迎大家评论区留言讨论哦!



太棒了! 十分感谢作者!
感谢![[爱]](data:image/png;base64,iVBORw0KGgoAAAANSUhEUgAAAEIAAABCCAYAAADjVADoAAALZElEQVR4nO1bW2xUxxn+xvae9a7XF2wD9q4T48BCY1qbpDGN5ISQJqFgSonURJUIKYq4KG3VpLzQJq0EvKRp1IekVaWksVU5raw2TaSg1oRSIlqnKAiTxHaKQzDYELy7oDXG2HjXu8t6+nB2jufMmTl7sU1Sie9lbv/8M/PNP5czZwa4hVu4BQnIzSoo3KpVFbjjD1PgHhCsAMXyVA3KCUgZAFBKB1NxZ0DxGQFO3og6hxZujx2b7/rNKxHhNmdzviv2OIBNhJA7ctWTIuj9ZNT5+nyRMudEpHr+aQo8OZvGq5Ai5bfJiPbnhTvil+ZK75wRYRBA8CwzdRGaxwd3yTJQ90KgeBFIabVZIBEFTUwBk1dArp5HZPws4tcDyjIppa8kI9qLc0HInBCRGgJvyCxA8/jgqn0YxPu1nPXTkUGQy6cwFvy3NY3SQQLsXbAFf8q5AMySiHCrVpXvjv+MEPKsmFZauxGk7l7A4ZpNERbQ4CeIXjhisRQKeig5qT2Vq3XkTESKhGOiFcwXASLo0HFEL31gIoRSOpiMOr+fy4SaExHhNmdzvjv2d34u0Dw+uBu3Ae7yXFTmhsgoMHTMMmQopbvLt+DlbFRlTcTVDmwFIX/k40qXPaZbAUMiqlsEc+cSou5EFDR8FtdOtZvlKN2/YAv2Zao2KyJEEjSPD67674G4F5gFhYpawMfL/Kp0mQxzE1FEetvNc0cWZGRMhDgcLCSoGq1q4DyARq4i2v8XkYwnM1lRMiJCnBiVlvAlgEgGBR1LRpzfTjeB5mWiPL8o/gd+dTBI4HtX1tNi3DxaA9NP3Avg8m+G5vEBAAhIWb4r9ka4Vauyy5qfTvfVDuwjhOxg4dJlj4FULDGber4DmL6hu4nojF+MY/JivCxvyh/45BO8+WonQmcHEQ1dxuLFhSCFxfK8Kf3EvQAFjjLEwr06GYQsII6k41dv45CqnbZDI9yqVRUUJUIsXOZ9AKhrTsedeoKTpdmlO1xo3deKgX7z5slf70NT01I0rrsXdqDDvbh2odMI34ho96mGiO3QyHfHX2R+zeMDrfm6tQEy2A2JdENI8Dc1LbWID/QH0NHehc72Tv3bRAFS02gMEQDId8d+oZRVJYjWUFq7EaSmUVnofIMmphA8M4R33/nIZCHllcXY8+unQByF8nxjAdMeQ2UVSosQrYHUNJrYZ36xR8R4lavy28l7l9dhx8+fwDPPb0J5ZTEAYHRkAm0vva3UR8p8GVmFlIhwq1ZFCNnGwq7ah0ETUyCOQtDElKmSfJyMFJYuxvN+lZyoh8G38k7s2f8dg4yB/gACpz5V6nP5Nxt5Ccj6cJvTMtFJiShwx59mfs3jA4oqLA1gFZNVnkbGEDwzhL6jPeg9fByYvCIlQGys6FfF0cQUUFSBrbvWoryyGP56H7x11VJ9NDEFOArNVuGK7RTrLJ0jRjtwju0bSms3AotXyMTMihyF6D18HN3d56Sz/PY9302rI1vYWZEFo5/j2tm3AKQ2WZPanfwne4EoH25zNhMSn/m09lTKFaeYBoC+oz041PkxRkcmpKLVNdIDq1mDJqZM9ZCCpZffbkQRkDIQshSAmoh8V6yJGYrm8QFaka5MhKNQOosDM+s8AFT6SuFdXqfUYYoXw7J41mjWQDsdPEGJKZR5HzA+2VOHysbqYSECBN9iXnfJMlBeOe9OXsFvXvibKeuadSvRsnmVTp5YaZkeMV4h13e0Bx3tXdYyZASIOrjyqcPDV3cTgJ+oiaBYzmYO6l5obgjn9p24aGTx1/uw4dG7LROWpXdFPRnI9f3ntEECAHQdPoXQ8Bi2796YmQ4e3DAnhNwRbnVUsXnCRIS+bCZm5gdnkVVZCg2rb8NwaCUAoOVxbjWKT6LvxEUMh/SVoqa6Qh8eIkkZ4lDnx5a4gf4AgkOh7HVqQnu4eaJAkmDNGJ/U/YIrEnDwQA+6Dp+S1qG8shjrN96Fhvu+otQnlhUMjCsn4J6TgzoRaXSIaZrHZ3yiF7hidUjNE9ahwTjw+HQFXEMthXCwIwHQd4Ad7V26dfhK5HoBoeLjSn3Sugh1kurnQAFjrJg2VCmG5ODNSlagAH+9D2vWrYS/3icX4HXIdGdQhlSOtwpRtzA0CGCs60qLUBYomlwKq+6ZmVpaNq8yZQ0GxtFzchA11RVma2A6RN0pv1fBoVie1CoUut0ly6R/zzIngkHWY6lKe32rpFm8vhJ5mtibkqG4Zdsa06oB6NYmHV52wySNhWV0VJcWmZpxDmhYfRvWrFtphP31Pmzf0ZRzPSLjZ6Xx2VlEbHJmSeX9svRM9djpTflbNq/Sh5udfjudClBgjPlNFnEj6hxifulfaF6xrBC+AQKCgXEcPNCDYGDcmldFrqhPDPPlZCObAgFGmN9sEZSeY97LPc3Tn71zxiCqbEne9PLNZXnwVAKxSZx5KzQ9dn5ans4jNongSNLYjoeGx7D9R2vT9yALZ+uK+QXS+Q7WOz7GSDHj9E/vS144GlfOHbUPatN26Yt3FaOhsXymcgBeeuE9jI5MoLyyGFt3rYW3Uj887+sdxaHOj/HVu29Hy3q/rsBZhLbf/QsA9LkgFzJ4l8FZBFwfMR/mTjqq2Rbb1KBwm7PZrpEAkC798u8nEBxJGpXo6x01doc8CQcPDaCjvQujIxP470efG/n7TlzEQH9A/6JNRK2mna3LDRGSuG6UQykdVJ5HfPhqw5uEs5ElIQ3+YQcGahI4Xx23NFqVfmrvMLwvL7Kcco8ErmEkAMvhzejIhPFfgn2jlFcWz80PZM4qhBXjfT5g9K5+IEO8LPxIdxH8ww4AgH/YgUe6zWMtXXpfv34s31DvMs4WO9q70NHeZZDA7zoPvjcMAIZ1VCwqwVyDnx8IcIRPM/50fTN09w8IIfcDek9XjFt/gi0NapjOI2g6LT8Rms4jGCtOAgAqSzBdUV9MkO9A3Z21GPg0hGhEtxp/vQ/rW+7ChpZliNN8XDgXxoVzYRz5x2lDZuvOtSh2p/qJ/U0TXT5N9AsgkTCmJi4A0I/qyrfgCT49650ls4KMkYjCWwrsef4h6d+slodqAMD0wbZm3UpjLrG9Y6G6hyG5NmAaFhQHRFXZb7GzgXB/QRoPnYyaav2kvNJXCm9p3P7+BNMh0aVy+WGRjDpfZ8smgzFH3Lu7u5/5ZRNjJuDzTfmdeaaKMjC/8Ouvod6FRn9SJ4GH7HegaCGqyygpRK/0GH5K6aDtn64bEe0IpTTIwgM1CatyG/DypXUFaKgXTNWu0qyS5jNFNTK5XpCSIYnr4iS5VyZuELFwR/wSBYyfhOer4xmTIS6fhY/M7426bMBfNKOUDqpuz5g2Rxu6u5+fpvSXLJwJGSIJzBrY5kXlqvx2ctm6/JAAgGREU95psOwSZWT8s0n+eSsj4Rs/1EAS10EdHqXLKsvieD+DGFbFycpg8cIdzFfsLqMqrwW829T0Qh4hz/Fx/KZJJIeRoIKsEWK8SiYXeXFIJCNac05EAHIyloQ0y6pS+6A2vaKlwGJdmfaqDJnKyWRNJEj+c8pg+wElDhPAurSKJPAzv6whfG/yEMOinJ28igQAIBQ/zuR+dsbXCz98rfFD/lsEAFbv7tbvVSkgM+N0c4FKTiXPw3J7f14unLZqVSdfa3wmj5DnSusKsOLRD4w09g7ji4L0Xcd8XkFmUF5K/wLIkJFwUy6lM6ieKdwsQhQE3NxnCgwpMl7k71sxzBchqudNX9jDFR5XO7CVAvtVT5kAzIoU9gmtIGAMFPuzHQoi5vSV39UO7Ev3uo+/1CUjhz83sH3YBjpGKF65EdFe/dI8buPBPXSVWshsMdcEMNyMB7A7Adw/qwewuvm3J6POv/7fPIBVQfUkmidI+iQ6oh2Zy56/hVu4hazwP/o9BcK8i2abAAAAAElFTkSuQmCC)
牛蛙![[害羞]](data:image/png;base64,iVBORw0KGgoAAAANSUhEUgAAAEIAAABCCAYAAADjVADoAAAJKklEQVR4nO1bUWgcxxn+5pxTLJ1y5xP1OT6p+JJabWPZxWmaBpkWO1QXLFDJS0OKLJBTnAdDoX3zi8EyGPoWyFMoCU0Cyr00L32KQSq2mxBaoyYYV3VsGXoGSVZV0EWy7nBO1k0fbmfvn39nZ3d1d0oC+l5m5p9/Zv7/23/m9nb/BXawAwqxnYuVJpFBDAcB9Esg54j7nHLeMagIYA413E2PYXm7bGsrEY7jwxL4GYCTMSH6AgcR1KScB3BZAJ+gho/aSUxbiCgVcEwCF2NCDLVy3pqU0wKYTI/i/VbOC7SQiNIkMjKGswDOBF35eDKHrsQBj7xSvgcA2FgrWteqSTkvgPOtJKQlRJQKGJfAJT8CUgeGge4M8J3vAR1d4SatViDXlyEWb6JSvmckp5WENEWEEwUfmLZAPJlDZ/8IRE+umSVcyJUixOJNrN6/5umrSTktajjVzBmyZSL8oiB1YBjIDYa/8hEh1/8HUfy7h5Bmo2NLRKwUcCEmxASVxZM5dA68CtG9dytTRoaFkImeUVyMOl9kIlYKeDsmxBkqSx58BeKpF6JO1RLI//wDa3f/rMlqUr7TM4rXo8wTi6JsJGHwXIOEasVc8npU+M1brUA89QKSg+c09ZgQZ1YKeDvKEqEjgpMQT+bQ9exvdKWOroaRtG5qR4FtLlKvfP4n7dclSmSEIoKfCan9x4Hv/8LfUJsTXGaq8zLMOgp3/qqdG2HPjEAiSgWMCyHeU21jJHzDwCNDSnk66NfEekaUJpGRwCUq6xx4tRkbtwXcRglcKk0iYxtjJcK5WXLvE5KD5yA6EvW+anlLZTNjTXOY+kVHAsnnfttwUog+GcMHNl99iSgVME7vGJMHX3EXk9UyREcidBkFpjm4nOr6yUV3pn5z1yBjqFTAeGQi6JaIJ3PA3qddp7iBtKTGUGN53aTHo03BFIXcFqqjZDL7o7rtxCe/LWIkwokGd0t09o9YnaZXnfbxaAjSs5Hkpxu0bZTtgLtFzsIAIxGeaAgIb+6Anzys3lbW8kVHov5z38AZk5qHCL9o+DZDZo+49ZgQfaUCjnEdDxESGFN1NxrUVaiW9XpQ2SqdZscoXxo+em6wNCJKk8jQX4rOzPPaZAC8xNA2h6mPj1F1Xpqg+v3GWMrOzPMNp4UY4oemHhExDGvtvU/bHaByVaeliRC/Oi9NhKv6VqIotU+3ifmqEeE8bQbghJLpagbVTfpRx5n6+AWgsB3mpI8emtRXwHtGnFSVrvQz/pN/nTCRF4XQBk7ShkuEcz40Hrt1W2/Nv50gz09jQvTRc6IREfU3UC7k7icAAOLhAwDAWnEJ0x9+jFszt10d1Udxa+Y2pj/8GGvFJU2Hl1zGx0XR9dPjfconk8+PEXG/qqifGvHwAeTuJyAePsC7717F4vyXAGaR7fscA0d6AQC9uQwWivWHx1MfzbqTzd5cwO8u/todz42gstWlMt5764o7R7ZvDwBg4EgvenP1i7ZQXMbszQXHhuA1uEwREk/m6F/0fgCfakRIIEcfTlASAGgGLM5/Sdqz8AM3xEYGhZpbEW+Dso86zmW8Tn1WdevfcGro6bMvulcqCNm+PXjpl88aDeXziocPkHoygfzwQOj51RqvvXZCs9U0t+1CUNCtYXxLpRY4dDiLQ4ez+Pe/Ft0w5VChfOhw1pUpAvjV4ATlR44iP3IUq0tlXJ+Zs87/TP8eiMcb70341Q5T5z4/xnuCoAjJjxz19JnCz3Sg2vpTTyYw9KufIz9iHxdljTCgW2O+2claYVAr5wkB12frGfHoRhqPbqTdtvyq4pGptvwq+qN6vzFcTtt8fZNsdans0QmCS4STqQKg/lr+0Y00Nm/vw+btfa4hm1/0ujJloGpvftGrGU1LkwwAxONdRj0TAXw95Si1U+ns/ttzmg5f1+QzjYg5qqQmVgarBQFg1w/+WzfKcR4Adv1wQXOOOmmSmaKB6/Gy+pcfa+spYmw28XlYeoHrc4OIGu6qauLR711xx8ufaQuqBVR0KCOUc9RRdbJ7rgST8zEmueagsx4nBoDHJm39dZY1QHx2iUiPYdnJWfJMRo3oePkzbUFqBAeNCJPjtM9vjAK1SV0Id30LMRrIW7KalPM0n4Iflpd3z/7BM1kYYmywHaRhDkzTFgxDDIdKTXJwmTY0IgTwibv44B8BAGsl6TEiaMFWg1+IIJv8IpSeD9RXp91AaRIZsUu43qX2H4dMZLBWkkim9dekXCY21iHj3UYDTH1++lyu2iYbgnToXKK8rL0clptyn+/WcM6JadVWoZTqJu8VNtY1mWpzw9ZKEm++cQXTU3c8YzUDN9YxPXUHb75xBWslCRnvNurx9cLo0DXotqhJOc3zrTy32AK4AGAIqIcSfVLFnVZG0FLh+syc9i81fyLrcRIApq4uun/fr8/MaXpUn89vWp/LKNi2mOR+e+4s06P4VP16AECldEsznC/MSZLxbqBacZ8jAPVnDFNXF7W9vbqe0EgAgJ/+pF+by+Qgr5vW5xGhfACcXwtDioBx03kSQw4Mm9Q0mK4CdxSA+1ebPt8AgPzwAPInyL9Ww3xbsQHVin42+ORKGIlw8if/qZ5hxpO5LT/Mnbq66HmyxHH67Is4lIv8RzgUKqVb7raoSTnfM4rvmvR8M2aMmTJbJGN1PWF8xjBwpBf5Y3valpNJSQDsmTPW1KGVAqbom6/U/uNmo1W+E63zHCibs6bxQeB6hjbLpZruGUXebzr7o7oaTtGDc/X+NT3FLyghTLVpv6k0kUDnDxpD4YxjJMyLGk7ZfLUSkR7DsgDOU5mW6aoc5PmUJsdNRnMHiCPWCDOtS8BupSGA80F52oEJp+lRvF+TckJbSP0c8Svvd+XC6ql+LgvSJ3KeyV+TciJMfnZzCaeGby48xvnBL5eyCX1DXnZrE04VTCnILBultYiQrdsMCUCLktKt0dFmmD5qaXtSOgD0jOJ1fmZsrBU9B9R2YPX+NRMJE1FJANrw4QrQ5u0C3yjY/g9XFGyfMgGt3TJ+33UBX/OnTBRBH7cBjTfsiphK+Z61TreahYBvxsdtHGEIUVCv53kZBs7d7juihrda9VFsuz6AHZfAWJs+gL2QHq3nNLQSO59EO9j5SH4HOzDi/+FVN6ddOdxKAAAAAElFTkSuQmCC)
谢谢支持。
可能是质粒太大了,菌顶不住就丢了,或者是抗性基因没选好?
请问一个质粒上能够同时存在两个NOS terminator吗
讲得挺好的,也挺详细,要多分析几种载体就更好了
太感谢了
很有收获诶 谢谢分享