质粒转染的操作步骤有哪些?
6 个回答
关注公众号“医学科研
概念:概括地说,转染是使用非病毒感染
转染的类型
根据导入的核酸存在于宿主细胞
瞬转:因为导入的核酸没有整合到宿主细胞基因组
稳转:外源DNA整合到细胞基因组中或作为附加体质粒保留在细胞中。与瞬时转染不同,稳定转染
由于稳转效率较低,因此选用有效地转染策略和筛选方法很重要。其中比较可靠地筛选方法是在DNA载体中包含选择性标记,然后在细胞转染
目前,由于各种转染试剂
瞬转和稳转的比较
| 瞬转 | 稳转 |
| 导入的DNA没有整合到基因组中,而是保留在细胞核 | 导入的DNA整合到基因组中 |
| 导入的遗传物质不传递到子代;遗传改变 | 导入的遗传物质能够代代相传;遗传改变是永久的 |
| 不需要选择性筛选 | 需要选择性筛选出稳定转染的细胞 |
| DNA载体和RNA都可用于瞬时转染 | 只有DNA载体可用于稳定转染;RNA本身不能稳定地导入细胞中 |
| 导入的遗传物质的高拷贝数导致高水平的蛋白质表达。 | 单拷贝数 |
| 通常在转染后24-96小时内收获细胞。 | 需要2-3周的时间筛选出稳定转染的细胞克隆 |
| 通常不适合使用具有诱导型启动子 | 适用于使用带有诱导型启动子的载体的研究。 |
转染方式
细胞由带负电荷
| 化学转染方法 | ||
| 技术 | 优点 | 缺点 |
| 阳离子脂质体 | 操作快速简单 结果可重复 转染效率高可转染DNA,RNA和蛋白质 适用于生产瞬时和稳定的蛋白质 可用于体内转染 | 需进行条件优化(一些细胞系对阳离子脂质体较敏感) 有些细胞系不容易转染 血清 培养基 |
| 磷酸钙共沉淀 | 便宜且容易获得 适用于生产瞬时和稳定的蛋白质 转染效率高(不限制细胞系) | 需要仔细制备试剂 – CaPO4溶液对pH,温度和缓冲盐浓度的变化敏感可重复性较差 有细胞毒性,尤其对原代细胞 不能采用RPMI培养基,由于其含高浓度的磷酸盐 不适用于动物体内转染 |
| 葡聚糖 | 操作简单 结果可重复 便宜 | 对某些细胞有化学毒性 只限于瞬时转染 转染效率低,尤其在原代细胞中 |
| 其他阳离子聚合物 | 在血清中稳定,对温度不敏感 高转染效率(限制细胞系) 结果可重复 | 对某些细胞有毒性 不能生物降解 只限于瞬时转染 |
| 生物转染方法 | ||
| 病毒转染 | 高转染效率(对原代细胞有80-90%) 适用于较难转染的细胞系 可用于体内转染 可用于构建稳定表达 | 被转染的细胞系必须含有病毒受体 基因插入大小受限(病毒载体 技术难度高,且构建重组蛋白很费时存在生物安全 |
| 物理转染方法 | ||
| 电转 | 原理简单 条件优化后可产生重复性的结果 不需要载体 不限制细胞类型和条件 条件优化后可以快速转染大量细胞 | 需要特殊的设备 需要优化电转脉冲和电压参数 对细胞伤害很大 细胞死亡 会不可逆转地损坏细胞膜,溶解细胞 |
| 生物传递粒子传递(粒子轰击 | 不限制细胞类型和条件 可用于动物体内转染 方法直接,结果可靠 不限制导入基因的大小和数量 主要用于基因疫苗和农业应用 | 需要昂贵的设备 会对样品产生物理损伤细 胞死亡率很高因此需要大量细胞 需要准备微粒 转染效率相对较低 对于研究应用成本较昂贵 |
| 显微注射 | 不限制细胞类型和条件 可以单细胞转染 方法直接,结果可靠 不限制导入基因的大小和数量 不需要载体 | 需要昂贵的设备 有技术要求,且是劳动密集型 常引起细胞死亡 |
| 激光介导的转染(光转染) | 可用于转染DNA,RNA,蛋白质,离子,葡聚糖,小分子和半导体 可用于非常小的细胞 允许单细胞转染或同时转染大量细胞不需要载体 转染效率高 适用于多种细胞系 | 需要昂贵的激光显微镜 需要贴壁细胞 有技术要求 |
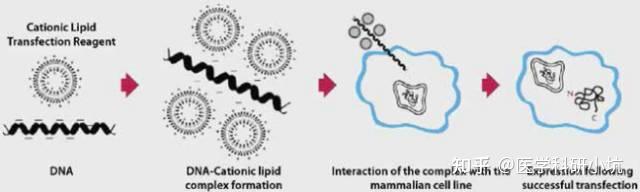
阳离子脂质体介导的转染
原理:阳离子脂质体介导的转染是目前最常用的转染方式之一。阳离子脂质的基本结构由带正电荷的头基和一个或两个烃链组成,带正电荷的头基与带负电荷的核酸通过静电作用
实验步骤:将DNA,RNA,siRNA或寡核苷酸和转染试剂分别在不同的管中稀释→将两者混合形成混合物→将形成的混合物加入细胞中,脂质体的正电荷有助于帮助复合物粘附到细胞膜上→复合物经细胞内吞作用
磷酸钙共沉淀
原理:将DNA与氯化钙
实验步骤:将氯化钙和DNA混合,以可控的方式加入磷酸缓冲液
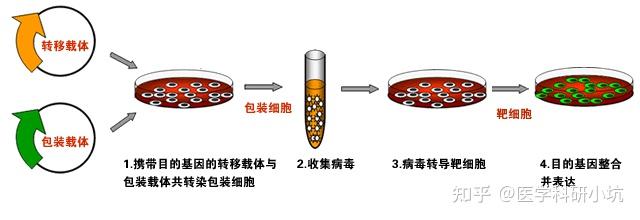
病毒转染
原理:对于用脂质体不能实现转染的细胞,可以采用病毒转染。腺病毒
实验步骤:通过基因克隆
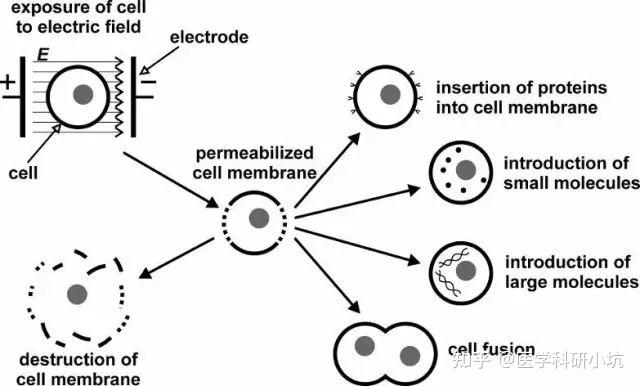
电转
原理:利用电脉冲在细胞膜上形成暂时的孔使核酸物质能穿过孔进入细胞。
实验步骤:利用电转缓冲液重悬细胞→对含有核酸,缓冲液,细胞的混合物给予合适的电脉冲→电脉冲在细胞膜上形成电势差,诱导产生暂时的孔使核酸进入细胞→将细胞返回
转染的影响因素
转染过程中许多因素会影响转染效率:如细胞种类、细胞密度;质粒大小、质粒纯度;血清;抗生素
转染实验中,以下几个因素需多加注意。
1. 转染前的细胞状态和密度
转染时细胞密度以 70~90%(贴壁细胞)或 2×10的6~4×10的6次方细胞 / mL(悬浮细胞
2. 转染时的质粒纯度
假使质粒不纯,如带少量盐离子,蛋白、代谢物污染等都会显著影响转染复合物的有效形成;而含有内毒素
3. 转染后的筛选时间
转染后筛选不能太早或太晚,因为转染了外源基因
4. DNA 与转染试剂的比例
许多转染方法需要优化 DNA 与转染试剂的比例。不同细胞系转染效率通常不同,细胞系的选择通常根据实验需要确定。在转染前应根据实验要求和细胞特性选择合适的转染试剂,不同转染试剂转染效率差别很大,好的转染试剂能让您事半功倍。
转染
1、种细胞;a、贴壁细胞:转染前一天每孔0.5-2×10E5个细胞接种于500ul培养基中,在转染时细胞可长至90-95%汇合度
2、转染液配置,每孔细胞用量如下:
A. 用50ul无血清培养基
3、在每孔细胞中加入混合后的转染液
4、贴壁细胞可在转染4-6h后更换完全培养基
材料试剂:胰化蛋白胨,酵母提取物
仪器:高压灭菌锅
实验步骤:
1. LB培养基的配制:
在950 ml去离子水
固态培养基
LB固体培养基
(1).配制:100mlLB培养基加入1.5g琼脂粉
(2).抗生素的加入:高压灭菌后,将融化的LB固体培养基置与55℃的水浴中,待培养基温度降到55℃时(手可触摸)加入氨苄抗生素
(3).倒板:一般10ml倒1个板子。培养基倒入培养皿
(4).保存:用封口胶封边,并倒置放于4℃保存,一个月内使用。
2. 从-70℃冰箱中取200μl感受态细胞悬液
3. 加入质粒DNA溶液
4. 42℃水浴中热击
5. 向管中加入1ml LB液体培养基(不含Amp),混匀后37℃振荡培养1小时,使细菌恢复正常生长状态,并表达质粒
6. 将上述菌液
同时做两个对照:
对照组
对照组2: 以同体积的无菌双蒸水代替DNA溶液,但涂板时只取5μl 菌液涂布于不含抗生素
大肠杆菌
1. 从LB平板上挑取新活化的单个菌落,接种于3-5ml LB液体培养基
2. 取上述培养液
3. 于4℃离心,2700rmp,10min,弃上清,收集细菌
4. 质粒的提取
准备大肠杆菌质粒提取盒和扩增的带质粒大肠杆菌培养液
5. 质粒鉴定(琼脂糖凝胶电泳
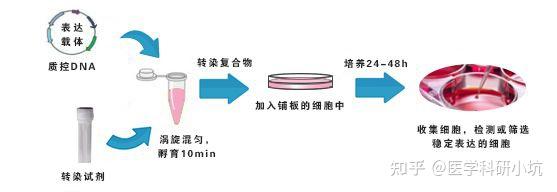
质粒转染
材料
细胞株、质粒、培养基、链霉素
实验步骤
Ⅰ.准备细胞:
贴壁细胞
II .对于每个转染样品,按下面的方法准备:
(1)用50 µL Opti-MEM
(2)轻轻颠倒混匀转染试剂,用50 µL Opti-MEM 稀释2.0 µL LipofectamineTM2000,轻轻吹吸3 - 5 次混匀,室温下静置5 min。
(3)混合转染试剂和质粒DNA稀释液
(4)转染复合物加入到24孔细胞
(5)将细胞板置于37℃、5% CO2 培养箱
稳定转染
从37℃,5%CO2孵育箱中取出培养皿,弃去含转染试剂
当正常细胞完全死亡后,换用新的不含G418的培养基培养。每天观察细胞生长状态。在细胞达到60%汇合率
当细胞达到90%以上汇合率时将细胞转移至培养瓶